Por Karina Toledo | Agência FAPESP – Estudios recientes han demostrado que las células progenitoras neurales –un tipo de células madre capaces de transformarse en neuronas y en células de la glía– constituyen los blancos de preferencia del virus del Zika a la hora de infectar el cerebro de bebés en gestación.
En una nueva investigación, dada a conocer por un consorcio formado por científicos brasileños, se detallaron los mecanismos moleculares que se activan durante la infección viral y que terminan ocasionando la muerte de dichas células.
Estos resultados pueden guiar a los científicos en la búsqueda de medicamentos capaces de evitar o al menos minimizar el daño que el virus ocasiona en el sistema nervioso central.
“Ya se sabía que las células progenitoras neurales son las que más mueren a causa de la infección por el virus del Zika; pero ahora hemos demostrado de qué manera mueren. Los datos indican que la replicación viral provoca una inestabilidad genómica, y esto resulta en una interrupción del ciclo celular. Las células no logran proliferar, ni tampoco iniciar el proceso de diferenciación, y terminan entonces entrando en apoptosis [muerte programada]”, dijo Juliana Minardi Nascimento, posdoctoranda del Laboratorio de Neuroproteómica del Instituto de Biología de la Universidad de Campinas (Unicamp), en São Paulo, y coautora del artículo.
 Estas conclusiones se basan en análisis de proteómica (del conjunto de proteínas presentes en las células) y de transcriptómica (del conjunto de genes expresados) realizados in vitro con cultivos tridimensionales de células progenitoras neurales.
Estas conclusiones se basan en análisis de proteómica (del conjunto de proteínas presentes en las células) y de transcriptómica (del conjunto de genes expresados) realizados in vitro con cultivos tridimensionales de células progenitoras neurales.
“En lugar de cultivar las células en placas de vidrio convencionales, las pusimos en rotación, en condiciones sumamente específicas, para que asuman un formato tridimensional y formen las llamadas neuroesferas. La formación de neuroesferas signa el comienzo del proceso de diferenciación celular o neurogénesis”, explicó Minardi Nascimento, cuya investigación, intitulada “Proteómica cuantitativa de linajes neurales y organoides cerebrales derivados de células madre con pluripotencia inducida de pacientes con esquizofrenia”, cuenta con el apoyo de la FAPESP.
La ventaja de este modelo reside en que mimetiza mejor el funcionamiento celular in vivo. “En el cultivo bidimensional, las células solamente logran interactuar con otras que se encuentran inmediatamente a su lado. En el modelo tridimensional, la comunicación se concreta con todas las que están alrededor, y esto se parece más al cerebro de un embrión en estadio rudimentario de desarrollo”, dijo la investigadora.
Antes de iniciar el procedimiento destinado a la formación de neuroesferas, los investigadores infectaron parte de las células con el virus del Zika. Utilizaron para ello una muestra del linaje brasileño aislado a partir de un paciente del estado de Pernambuco.
“Los cultivos permanecieron en contacto con el virus durante dos horas. Luego se lo inactivó y comenzó el proceso de inducción de neuroesferas. Las células infectadas llegaron a congregarse en esferas, pero no progresaron mucho. Al cabo de seis días, las neuroesferas empezaron a deshacerse. Después de doce días, no quedaba prácticamente nada en los cultivos infectados”, comentó Minardi Nascimento.
Al tercer día después de la infección, el grupo observó que los cultivos expuestos al virus del Zika habían crecido un 40% menos que los del grupo de control. Los análisis de proteómica indicaron 458 proteínas alteradas, de las cuales 199 estaban menos expresadas que en las células de control y 259 aparecían con su expresión aumentada.
“Muchas proteínas de traducción [que traducen el ARN mensajero para formar una nueva proteína] estaban alteradas, lo que es común en infecciones virales, pues ese tipo de patógeno utiliza la maquinaria de la célula para producir sus propias proteínas. También notamos un incremento de la expresión de moléculas relacionadas con la reparación de ADN, tal como la BRCA1. Esto indica que la replicación viral estaba generando errores en el material genético y dejando inestable a las células”, dijo Minardi Nascimento.
Sin embargo, lo que más llamó la atención de los investigadores fue el cambio del perfil de expresión de proteínas relacionadas con el ciclo celular.
“Los resultados indican que el ciclo celular se interrumpió muy tempranamente, antes de que las células empezasen a duplicar su material genético. También fue posible ver que esa pausa no estuvo motivada por el comienzo del proceso de diferenciación, pues las proteínas relacionadas con la neurogénesis se encontraban disminuidas en número con relación a las neuroesferas de control”, dijo Minardi Nascimento.
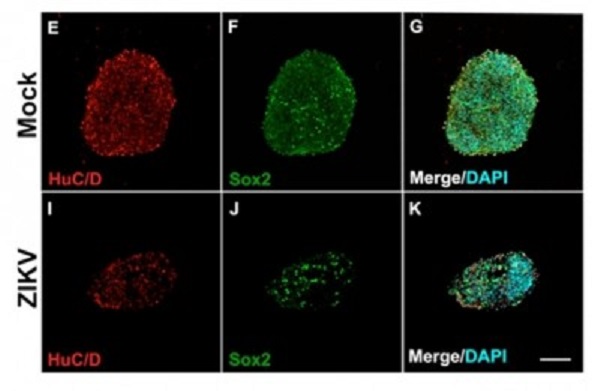
Al sexto día después de la infección, la cantidad de neuroesferas de control era un 50% mayor que la de aquéllas expuestas al virus. Las células no infectadas también habían avanzado mucho más en el proceso de diferenciación en neuronas, cosa que quedó evidente a causa de la mayor presencia de proteínas que funcionan como marcadores específicos para este tipo de células.
“En las neuroesferas expuestas al virus del Zika, la cantidad de marcadores relacionados con neuronas había disminuido bastante. Por otra parte, observamos la presencia de caspasa 3 activa, una proteína indicadora de apoptosis. Otro indicio de que las células estaban muriéndose fue la presencia de núcleos muy condensados”, dijo la investigadora.
En los análisis realizados al 12º día después de la infección, se observó una cantidad diez veces menor de neuroesferas infectadas en comparación con el grupo de control. “En experimentos in vitro, pueden ser necesarios alrededor de 21 días para obtener una neurona joven funcional a partir de una célula progenitora neural. Pero en este estudio, demostramos que la mayoría de las células progenitoras infectadas por el virus del Zika no duran siquiera 12 días. Es un proceso rápido de muerte”, dijo.
Colaboraciones
Los experimentos in vitro se realizaron en Río de Janeiro, bajo la coordinación de Patrícia Garcez y Stevens Rehen, científicos de la Universidad Federal de Río de Janeiro (UFRJ) y del Instituto D’Or de Pesquisa e Ensino (Idor).
Los análisis de proteómica se hicieron en la Unicamp y, además del trabajo a cargo de Minardi Nascimento, contaron con la colaboración de la posdoctoranda Juliana Silva Cassoli y con la coordinación del profesor Daniel Martins de Souza. Los ensayos de transcriptómica se concretaron en la ciudad de Belém (en el estado de Pará), y estuvieron a cargo de colaboradores del Instituto Evandro Chagas. Los resultados se remitieron a una revista de alto impacto para su análisis y, en función de la relevancia del tema para la salud pública, se los subió para que queden disponibles online antes incluso de la conclusión del proceso de revisión por pares.
La versión preliminar del artículo intitulado Combined proteome and transcriptome analyses reveal that Zika virus circulating in Brazil alters cell cycle and neurogenic programmes in human neurospheres (doi.org/10.7287/peerj.preprints.2033v1) puede leerse en el siguiente enlace: peerj.com/preprints/2033/.