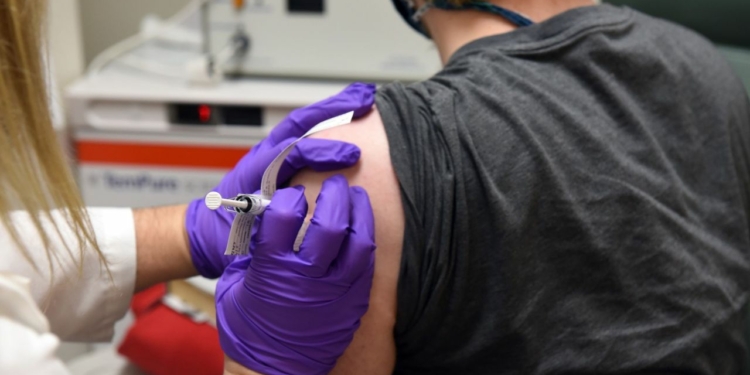
El suministro se haría progresivamente en el 2021, iniciando en el primer trimestre de ese año sujeto a la aprobación regulatoria del Ministerio de Salud
SAN JOSÉ, COSTA RICA y MAINZ, ALEMANIA, 01 de octubre de 2020 — Pfizer Costa Rica y BioNTech SE anunciaron hoy un acuerdo con el gobierno de Costa Rica y la Comisión Nacional de Emergencias (CNE) para suministrar su vacuna candidata BNT162b2, basada en ARNm, contra el SARS-CoV-2, sujeta al éxito del estudio clínico y aprobación regulatoria.
El gobierno de Costa Rica recibirá 3 millones de dosis, tras la autorización del Ministerio de Salud. No se revelaron los detalles financieros del acuerdo. A petición del gobierno costarricense, las entregas se realizarán progresivamente en el 2021, sujetas al éxito clínico y la aprobación regulatoria local.
"Nos sentimos profundamente honrados de trabajar con el gobierno de Costa Rica y de orientar nuestros recursos científicos y de producción hacia nuestro objetivo común, proporcionando a los costarricenses una potencial vacuna contra el COVID-19 lo más rápido posible", indicó Bradley Silcox, Gerente General de Pfizer Centroamérica y Caribe (CAC). "Ante esta crisis sanitaria mundial, el propósito de Pfizer – innovaciones que cambian la vida de los pacientes– ha adquirido una urgencia aún mayor. Nuestra esperanza es que, sujeta al éxito clínico y regulatorio, nuestra vacuna ayude a que esto suceda".
"Quisiera agradecer al gobierno de Costa Rica por su apoyo y por confiar en nuestra capacidad para desarrollar una vacuna que, creemos, tiene el potencial para ayudar a enfrentar la amenaza global de esta pandemia. Nuestro objetivo sigue siendo mantener una provisión mundial de una vacuna contra el COVID-19 segura y eficaz para muchas personas en todo el mundo, lo más rápido posible", dijo Sean Marett, Director de Negocios y Director Comercial de BioNTech.
Además de los compromisos con los gobiernos, Pfizer y BioNTech han manifestado su interés en un posible suministro a COVAX Facility, un mecanismo establecido por la Alianza Mundial para la Vacunación (GAVI, por sus siglas en inglés), la Coalición para las Innovaciones en la Preparación ante Epidemias (CEPI) y la Organización Mundial de la Salud (OMS) que tiene por objeto proporcionar a los gobiernos, incluidos los de mercados emergentes, un acceso temprano a una amplia cartera de vacunas candidatas COVID-19, utilizando una serie de plataformas tecnológicas, producidas por múltiples fabricantes de todo el mundo.
Sobre la candidata BNT162
El programa BNT162 se basa en la tecnología de ARNm, patentada por BioNTech y está respaldado por las capacidades globales de desarrollo y fabricación de vacunas de Pfizer. En julio, dos de las cuatro candidatas a vacunas que investigaban nuestras compañías, BNT162b1 y BNT162b2, recibieron la designación de Vía Rápida por parte de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Esta designación se concedió sobre la base de datos preliminares de los estudios en fase 1/2 que se están llevando a cabo actualmente en Estados Unidos y Alemania, así como de estudios de inmunogenicidad animal.
El 27 de julio, Pfizer y BioNTech anunciaron que luego de un análisis exhaustivo de los datos preclínicos y clínicos de los ensayos clínicos de fase 1/2, y en consulta con el Centro de Evaluación e Investigación Biológica de la FDA (CBER) y otros organismos reguladores mundiales, las empresas seleccionaron la vacuna candidata BNT162b2 para pasar a un estudio de fase 2/3. La BNT162b2 codifica una glicoproteína pico de tamaño completo (S) del SARS-CoV-2 optimizada, que es el objetivo de los anticuerpos neutralizadores del virus.
Sobre el estudio fase 2/3
En la última etapa del ensayo, las compañías estudiarán una dosis de 30 µg en un régimen de dos dosis entre 44.000 participantes de 16 a 85 años. Se espera incluir aproximadamente 120 sitios en 3 países, incluyendo regiones donde se prevé una importante transmisión del SARS-CoV-2.
Asumiendo el éxito clínico, Pfizer y BioNTech están en camino de conseguir la revisión regulatoria de BNT162b2 antes de fin de año y, si se obtiene la autorización o aprobación regulatoria, planean suministrar hasta 100 millones de dosis en todo el mundo para fines de 2020 y aproximadamente 1.3 billones de dosis para fines de 2021.
La vacuna candidata BNT162 no está actualmente aprobada para su distribución en ningún lugar del mundo. Ambos colaboradores están comprometidos con el desarrollo de estas nuevas vacunas con datos preclínicos y clínicos al frente de toda su toma de decisiones.